核酸现场检测技术具备检测速度快、操作简单、仪器便携、无需专业实验室和检测人员,且能实现单样本随到随检等优点,对核酸检测能力下沉至基层,以及传染性疾病的早诊早治和防控具有重要意义。近年来,CRISPR/Cas12a被发现可通过crRNA引导识别靶核酸后激活反式切割活性,水解信号探针,从而实现检测信号的放大。由于该过程可在能耗较低的恒温条件下进行,因而具备应用于核酸现场检测的潜力。然而,CRISPR/Cas12a反式酶切信号探针的检测灵敏度仅能达到皮摩尔水平,难以满足临床需求。将其与等温核酸扩增技术联用,既能解决灵敏度不足问题,又能弥补部分等温扩增技术特异性不佳的短板。早期研究采用“先扩增后检测”两步法策略实现二者的联用,但过程中需开盖移液,极大地增加了气溶胶污染的风险。而直接混合的一步法可规避该风险,但其灵敏度相较两步法存在显著下降。
对此,实验室夏宁邵、葛胜祥、张师音团队首先探明并验证了一步法检测中灵敏度低是等温扩增与CRISPR/Cas12a体系竞争扩增模板和产物所导致的;并开发了一种名为HPL-opCRISPR的一管式检测方法,用以克服一管检测中重组酶聚合酶扩增(RPA)和CRISPR/Cas12a系统兼容性差、灵敏度低的问题。该方法应用赋型冷冻干燥技术分别将RPA扩增体系与CRISPR/Cas12a检测体系制备为独立的扩增微球与检测微球,并在检测微球表面包裹低熔点石蜡,制备为热启动CRISPR/Cas12a微球。最后将双微球预装载于同一管中,即可用于检测:首先通过加入的液态模板融化扩增微球,并在相对较低的39℃恒温下进行RPA反应;其后升温至45℃,使热启动CRISPR/Cas12a微球表面石蜡融化,释放检测微球;液相RPA产物融化检测微球后,释放CRISPR/Cas12a检测体系,crRNA-Cas12a被RPA产物激活,反式切割FQ-报告探针,产生检测信号。
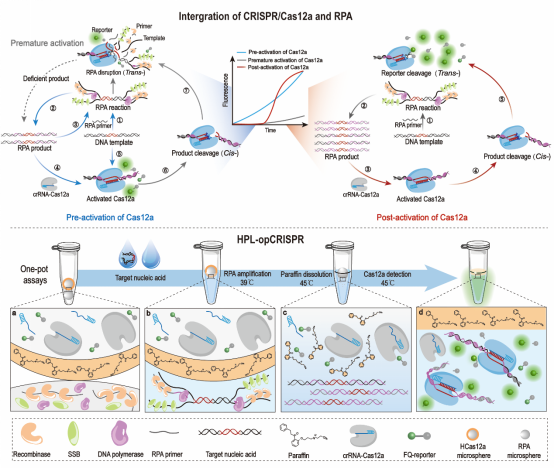
HPL-opCRISPR一管式检测方法示意图
HPL-opCRISPR巧妙利用石蜡熔点与RPA扩增的温度差,通过简单的温度控制实现相转换的策略,即可于密闭的一管内完成检测。这不仅解决了一步法检测中RPA与CRISPR/Cas12a系统兼容性差、灵敏度低的问题,还实现了加样后全系统封闭,可有效避免产物外泄造成的气溶胶污染。此外,双冻干微球相较液相体系具备更加优秀的稳定性,可摆脱冷链在常温下保存和运输,进一步推动了CRISPR/Cas12a技术在核酸现场检测中应用的进程。
基于HPL-opCRISPR方法,研究人员开发了猴痘病毒核酸快速检测试剂。经与深圳市疾病预防控制中心合作进行性能评价,HPL-opCRISPR灵敏度与PCR相当,且能准确区分猴痘病毒核酸与其他正痘科病毒,如天花病毒和牛痘病毒,以及其他病毒核酸,具备理想的特异性。
近日,该研究成果以“Heat-triggered CRISPR/Cas12a microspheres for one-pot assays”为题在线发表于《科学通报》(Science Bulletin)。这是实验室继在Clinical Biochemistry(2020)、Analytica Chimica Acta(2021)、Talanta(2021)和Sensors and Actuators: B. Chemical(2024a,2024b)上发表有关检测试剂冻干技术及核酸现场检测的系列研究论文后取得的又一项重要成果。实验室谢思盈、邵珊、王进和深圳市疾病预防控制中心屈静为该论文共同第一作者。实验室夏宁邵、葛胜祥、张师音和深圳市疾病预防控制中心石晓路为该论文共同通讯作者。该研究得到国家重点研发计划、国家自然科学基金、福建省自然科学基金、厦门市自然科学基金、中国医学科学院创新单元项目、中央高校基本科研业务费专项资金以及广东省科技计划项目等项目支持。
文章链接:https://www.sciencedirect.com/science/article/abs/pii/S2095927324009393
